Une nouvelle approche dans la prise en charge du SAOS
Dans toutes les spécialités, l’usage des biomarqueurs occupe une place prépondérante lors de la prise en charge des patients. Ils sont des indicateurs particulièrement intéressants pour le diagnostic, le pronostic et le suivi des pathologies. Ils pourraient bien être utilisés également dans la prise en charge du SAOS afin de personnaliser et optimiser les traitements.
L’exploitation des données récoltées lors des enregistrements type polysomnographie ou polygraphie du sommeil est intéressante pour évaluer la qualité et la durée du sommeil. Elle permet le diagnostic d’apnées, au moyen de l’indice d’apnée-hypopnée (IAH), mais pas d’apporter des précisions quant aux conséquences physiologiques des apnées et, ainsi, la prévention des complications, notamment cardiovasculaires.
Des biomarqueurs d’intérêt
Afin d’améliorer la prise en charge de l’apnée du sommeil ont été recherchés, et notamment par le groupe de travail de Boston aux États-Unis, de nouveaux indicateurs extraits des enregistrements. Ces derniers se trouvent avoir une valeur prédictive meilleure que l’IAH vis-à-vis du risque de complications cardiovasculaires, mais également de cardioprotection de la PPC (pression positive continue). Deux types de biomarqueurs ont été investigués : la charge hypoxique et la réponse du système nerveux autonome.
L’hypoxic burden
Cet indicateur permet de mesurer la profondeur et la durée des désaturations en lien avec les apnées du sommeil. Il est capable de mieux prédire le risque de complications cardiovasculaires (morbidité et mortalité cardiovasculaire) et cela a été prouvé dans plusieurs cohortes prospectives épidémiologiques et cliniques (notamment celle des Pays de la Loire), et d’identifier les patients qui seraient le plus à même d’être protégés du risque cardiovasculaire par la PPC (Fig. 1 et 2) [1, 2].
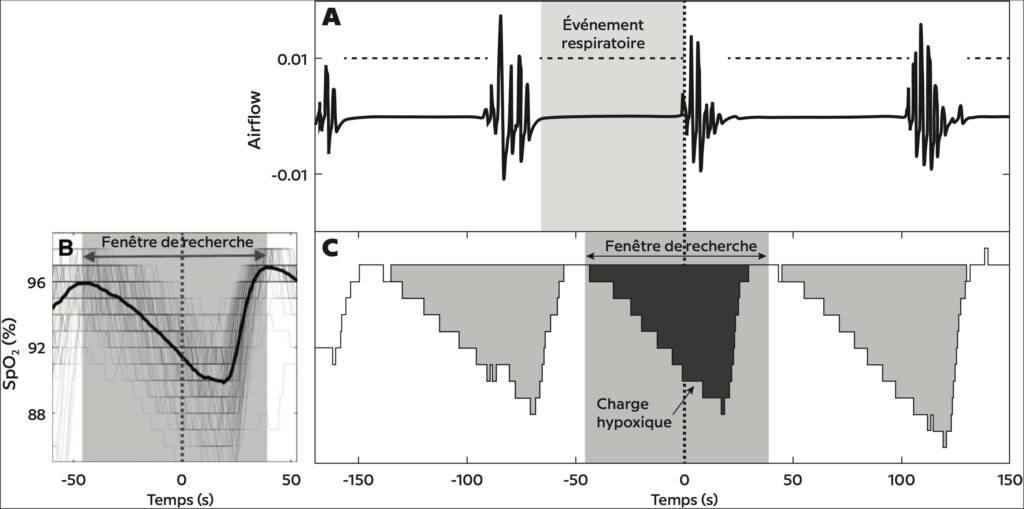
Figure 1 – Exemple de calcul de la charge hypoxique pour un événement respiratoire individuel. (A) Le débit d’air de la canule nasale et les événements respiratoires annotés sont représentés. (B) La superposition des signaux de saturation en oxygène (SpO2) associés à tous les événements respiratoires d’un individu est illustrée. Ces signaux ont été synchronisés à la fin des événements respiratoires (temps zéro) et moyennés pour calculer la fenêtre de recherche (temps entre deux pics). La fenêtre de recherche a été utilisée pour calculer la charge hypoxique pour des événements individuels. Il s’agit de la surface sous la courbe de saturation à l’intérieur de la fenêtre de recherche (C). La charge hypoxique totale a été définie comme la somme des charges individuelles divisée par le temps de sommeil total.
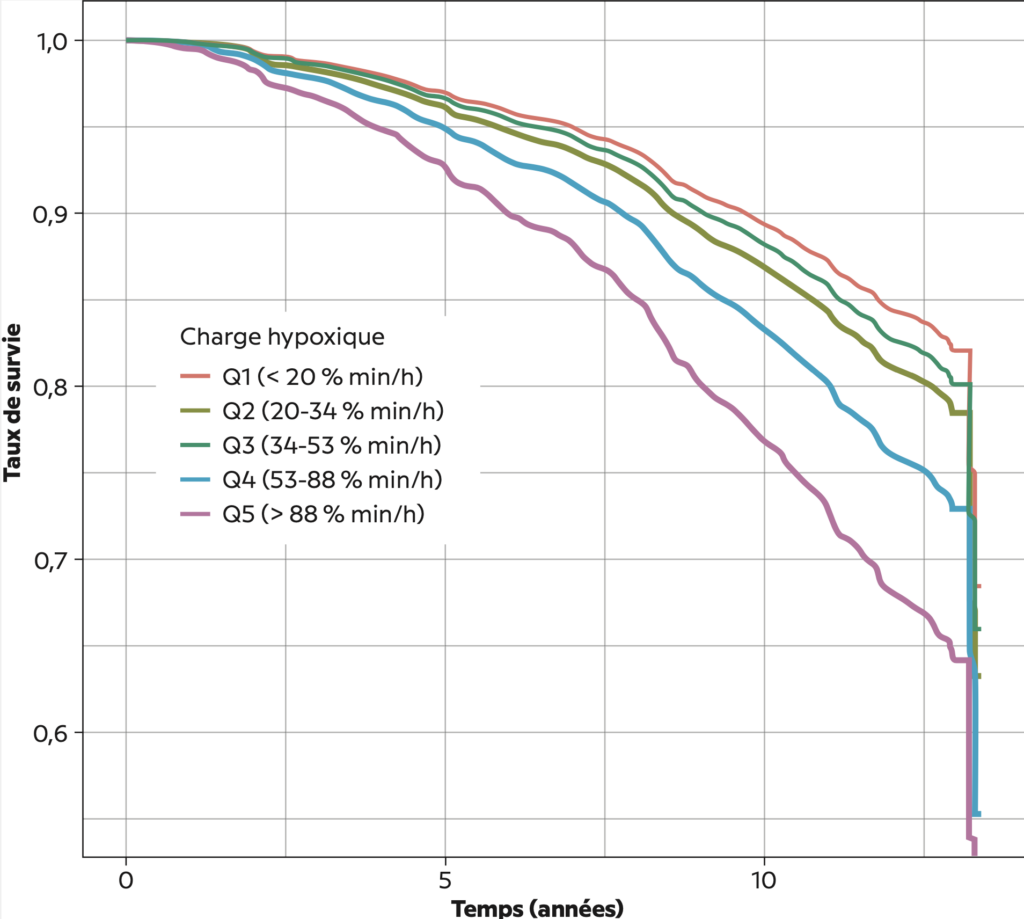
Figure 2 – Courbe de survie ajustées pour la mortalité cardiovasculaire selon les catégories de la charge hypoxique dans MrOS. Ces courbes ont été obtenues à partir du modèle 4. Les courbes de survie ajustées ont été obtenues en faisant la moyenne des courbes de survie prédites pour chaque observation de l’étude MrOS.
Les indicateurs de la réponse du système nerveux autonome
Ils s’intéressent au système nerveux autonome et à la réponse autonomique vis-à-vis des événements respiratoires obstructifs pendant le sommeil. En effet, tous les patients, à IAH égal, ne répondent pas de la même manière aux événements respiratoires, et la réactivité autonomique au cours du sommeil pourrait permettre d’estimer le niveau de risque cardiovasculaire et la réponse à la PPC.
Le delta heart rate
Il correspond à l’amplitude d’augmentation de la fréquence cardiaque qui fait suite à un événement (apnée ou hypopnée). Une étude suggérerait que ce biomarqueur permettrait également de prédire la réponse à la PPC. Ceux ayant une réponse plus marquée aux événements seraient ceux qui seraient mieux protégés par la PPC (Fig. 3 et 4) [3].
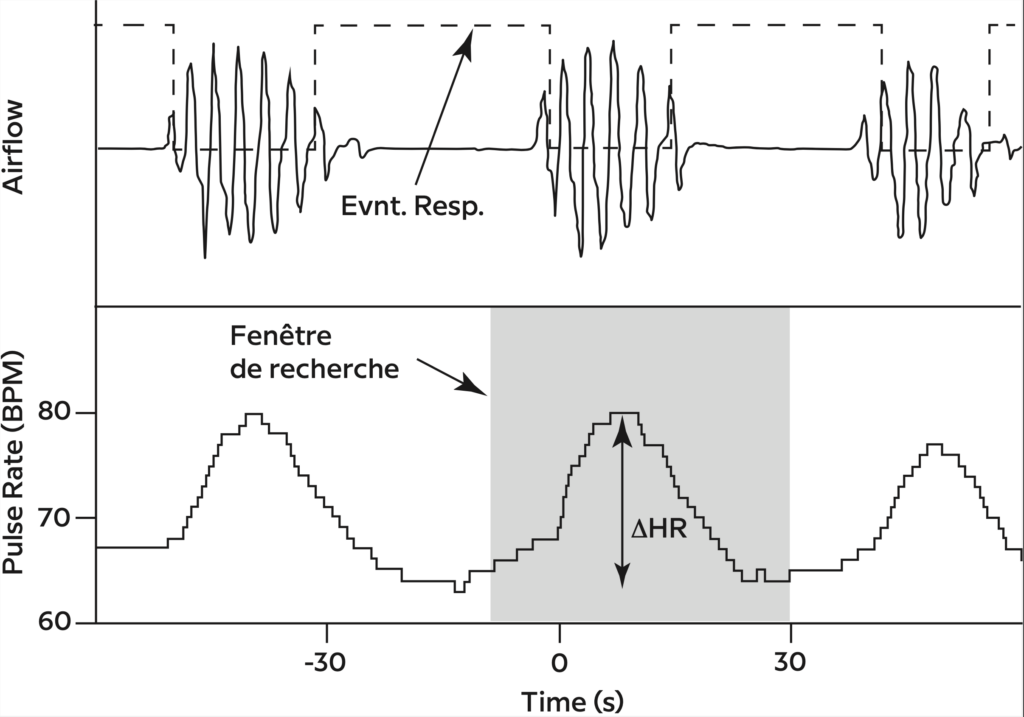
Figure 3 – La réponse de la fréquence du pouls à chaque événement respiratoire individuel (ΔHR) a été définie comme la fréquence maximale du pouls pendant une fenêtre de recherche spécifique au sujet (voir la figure E1 pour plus de détails) et la fréquence minimale du pouls pendant cet événement. Le ΔHR individuel a été défini comme la moyenne de toutes les réponses spécifiques à l’événement. BPM = battements par minute.
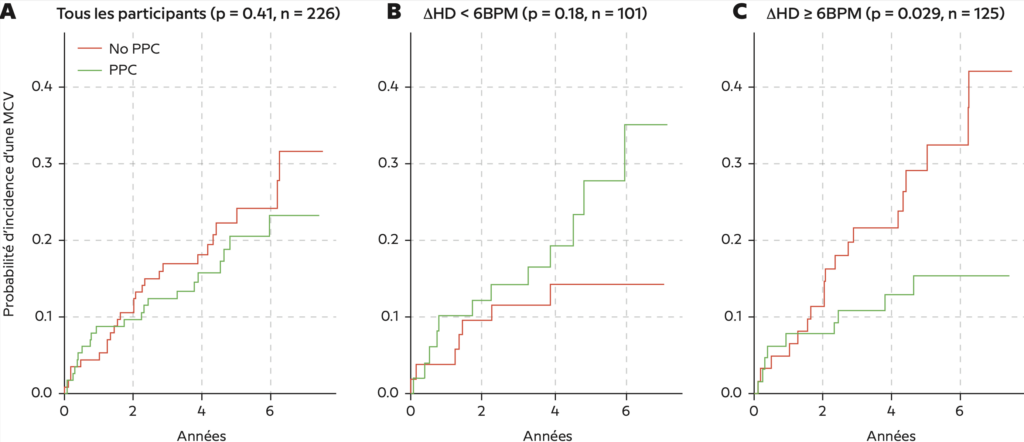
Figure 4 – La courbe de survie de Kaplan-Meier non ajustée montre un avantage préférentiel de la pression positive continue (PPC) chez les personnes ayant une réponse élevée de la fréquence du pouls aux événements respiratoires (ΔHR ; ΔHR ≥ 6 BPM). Aucun effet significatif n’a été observé chez tous les participants. Il a été suggéré que la PPC pouvait être nocive pour les personnes ayant un faible ΔHR (ΔHR < 6 BPM). BPM = battements par minute ;
MCV = maladies cardiovasculaires ; ΔHR = réponse de la fréquence du pouls aux événements respiratoires.
L’indicateur PWAD
De plus, un autre indicateur a été co–investigué sur trois cohortes (ISAAC [Espagne], HypnoLaus [Suisse] et cohorte sommeil des Pays de la Loire [France]) : l’indicateur PWAD (pulse wave amplitude drops) [4]. Indépendamment des événements respiratoires nocturnes survient parfois un aplatissement de l’onde de pouls (les PWAD) qui peut se mesurer avec un oxymètre et traduit une réactivité autonomique et vasculaire au cours du sommeil. L’indicateur consiste ainsi à mesurer le nombre de ces aplatissements par heure d’enregistrement ou de sommeil au cours de la nuit. De la même façon, nous avons montré sur les trois cohortes que les patients au PWAD bas (moins d’aplatissements), et particulièrement ceux ayant une apnée du sommeil, ont un risque cardiovasculaire plus important. Enfin, chez ces patients au PWAD haut, l’adhérence à la PPC apporterait une plus grande protection cardiovasculaire que chez ceux à PWAD bas (Fig. 5 et 6).
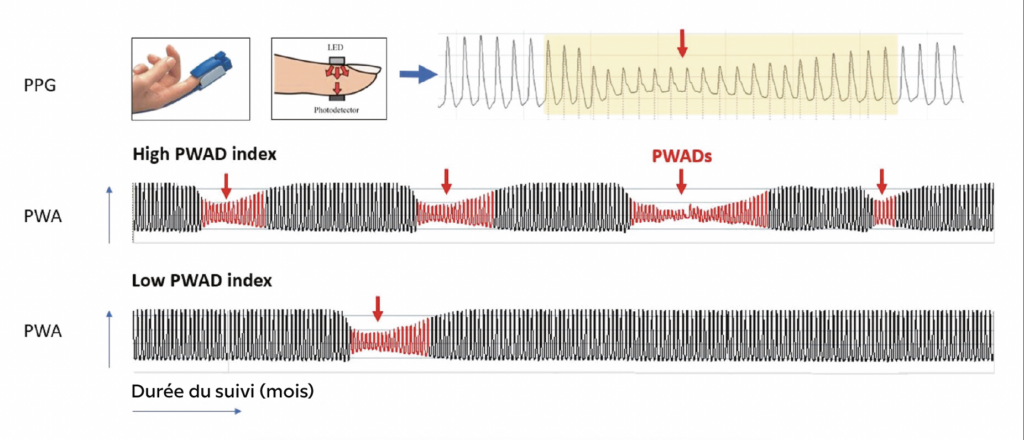
Figure 5 – Évaluation de la PPG et de la PWA. PPG = photopléthysmographie ; PWA = amplitude de l’onde de pouls ; PWAD = chute de l’amplitude de l’onde de pouls.
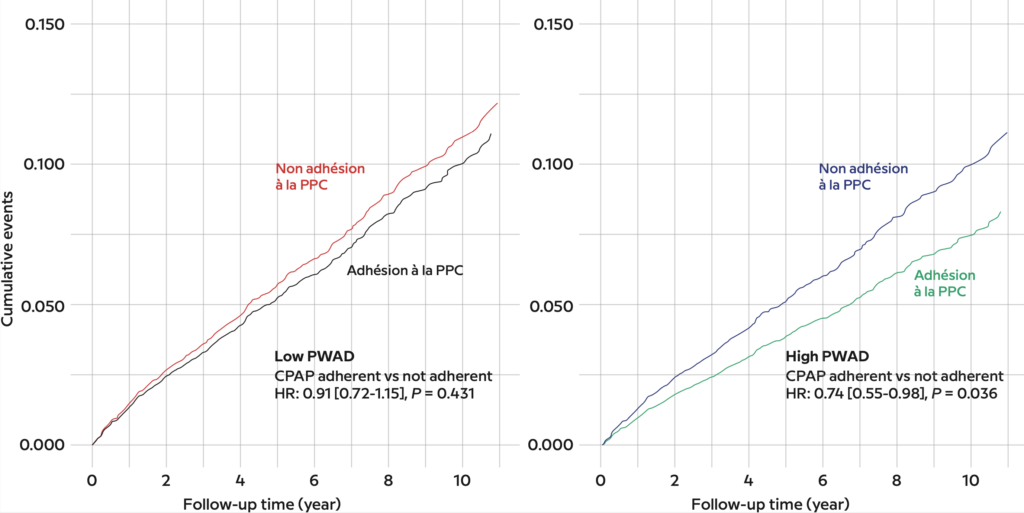
Figure 6 – Cohorte du sommeil des Pays de la Loire : courbes de régression de Cox ajustées montrant l’incidence des événements cardiovasculaires majeurs en fonction de l’utilisation (ou non) de la pression positive continue (PPC) en cas d’indice élevé (à gauche) ou faible (à droite) de chute de l’amplitude de l’onde de pouls (PWAD). Les modèles ont été ajustés en fonction de l’âge (continu), du sexe (catégorique), de l’indice de masse corporelle (continu), du diabète (catégorique), de l’hypertension (catégorique), du tabagisme (catégorique), du type d’étude du sommeil (catégorique), du site d’étude (catégorique), des médicaments β-bloquants/anti-canaux calciques (catégorique) et du statut du traitement (catégorique). Description des groupes (n, valeur médiane de l’indice PWAD en n/h [intervalle de confiance à 95 %]) : indice PWAD élevé-adhésion à la PPC (1 382, 60,7 [53,7-70,3]), indice PWAD élevé-non-adhésion à la PPC (454, 61. 3 [52,9-69,6]), indice PWAD faible – adhésion à la CPAP (1 308, 33,2 [24,1-40,8]) et indice PWAD faible – pas d’adhésion à la CPAP (525, 33,3 [25,8-39,9]). HR = hazard ratio.
Ces biomarqueurs seraient ainsi capables d’évaluer le risque de complications cardiovasculaires et prédire le degré de protection cardiovasculaire de la PPC, soit via les données de l’hypoxie, soit via celles de réactivité aux événements respiratoires. Ils permettraient une personnalisation et une optimisation de la prise en charge.
Pour ce biomarqueur, il est encore nécessaire de développer des algorithmes pour extraire cette donnée des enregistrements et de définir les seuils qui permettraient de l’utiliser en pratique clinique. L’intérêt de combiner ces indicateurs devra également être étudié.
Quel avenir en pratique clinique ?
Outre l’intérêt physiologique, l’exploitation de ces biomarqueurs permettrait de faire une évaluation en utilisant un seul et même capteur : l’oxymètre.
C’est potentiellement intéressant pour la pratique clinique d’un point de vue bénéfice-coût, car ces biomarqueurs nouveaux sont intéressants, prédictifs et accessibles. Ils rentreront sûrement dans le nouvel arbre décisionnel quant aux choix thérapeutiques.
La question qui se pose désormais est celle de la hiérarchisation de l’utilisation de ces biomarqueurs les uns par rapport aux autres.
Références :
1. Trzepizur W, Blanchard M, Ganem T et al. Sleep Apnea-Specific Hypoxic Burden, Symptom Subtypes, and Risk of Cardiovascular Events and All-Cause Mortality. Am J Respir Crit Care Med 2022 ; 205 : 108-17.
2. Azarbarzin A, Sands SA, Stone KL et al. The hypoxic burden of sleep apnoea predicts cardiovascular disease-related mortality: the Osteoporotic Fractures in Men Study and the Sleep Heart Health Study. Eur Heart J 2019 ; 40 : 1149-57.
3. Azarbarzin A, Zinchuk A, Wellman A et al. Cardiovascular Benefit of Continuous Positive Airway Pressure in Adults with Coronary Artery Disease and Obstructive Sleep Apnea without Excessive Sleepiness. Am J Respir Crit Care Med 2022 ; 206 : 767-74.
4. Solelhac G, Sánchez-de-la-Torre M, Blanchard M et al. Pulse Wave Amplitude Drops Index: A Biomarker of Cardiovascular Risk in Obstructive Sleep Apnea. Am J Respir Crit Care Med 2023 ; 207 : 1620-32.



